Ondanks het succes van de huidige therapieën voor acuut myocardinfarct (MI), ontwikkelen veel patiënten nog steeds ongunstige remodellering van het hart en hartfalen. Met de groeiende prevalentie van hartfalen is een nieuwe therapie nodig die remodellering kan voorkomen en weefselherstel kan ondersteunen. Hierin rapporteren we over injecteerbare recombinant humaan collageen type I (rHCI) en type III (rHCIII) matrices voor het behandelen van acuut myocardinfarct. Het injecteren van rHCI- of rHCIII-matrices in muizen tijdens de late proliferatieve fase na MI herstelt de mechanische eigenschappen van het myocardium en vermindert de littekengrootte, maar alleen de rHCI-matrix behoudt de wanddikte op afstand en voorkomt hartvergroting. De behandeling met rHCI verhoogt de aantallen cardiomyocyten en capillairen in de grenszone en de aanwezigheid van pro-wondgenezende macrofagen in het ischemische gebied, terwijl de algehele werving van beenmergmonocyten wordt verminderd. Onze bevindingen tonen functioneel herstel na MI met behulp van rHCI door het bevorderen van een genezende omgeving, overleving van cardiomyocyten en minder pathologische remodellering van het myocardium.

Invoering
Hart- en vaatziekten zijn de belangrijkste oorzaak van wereldwijde morbiditeit en zijn verantwoordelijk voor meer dan 17 miljoen sterfgevallen per jaar1. Kransslagaderziekte blijft de meest voorkomende CVD en wordt veroorzaakt door accumulatie van atherosclerotische plaque in de epicardiale slagaders die het myocardium2 leveren, die de bloedstroom kunnen beperken die leidt tot een acuut myocardinfarct 1,3. Chirurgische procedures die de bloedtoevoer naar de met littekens bedekte hartspier na MI herstellen, verbeteren de resultaten van de patiënt; ze slagen er echter niet in om de hartfunctie te herstellen. Gemiddeld ontwikkelt 10% van de post-MI patiënten ongunstige ventriculaire remodellering die uiteindelijk zal leiden tot gevorderd hartfalen1, met een 5-jarige mortaliteit van ~ 50% 4. Ondanks enorme inspanningen bij het ontwikkelen van biologische therapeutica om hartspierbeschadiging en disfunctie na MI te overwinnen, is het steeds duidelijker geworden dat geneesmiddelen met kleine moleculen, groeifactoren en zelfs op cellen gebaseerde therapieën momenteel suboptimaal zijn voor het herstellen van de hartfunctie5,6,7. Het beperkte endogene vermogen van de hartspier om te genezen8 en modificatie van de cardiale extracellulaire matrix (ECM) 9 zijn twee sleutelfactoren die reparatie en regeneratie remmen. Er is dus een nieuwe therapie nodig die tegelijkertijd nadelige remodellering kan voorkomen en een geschikte ECM-omgeving kan bieden om cel- en weefselherstel te ondersteunen, evenals functioneel herstel. Na acuut myocardinfarct wordt ECM-eiwitmodificatie geïnitieerd tijdens de ontstekingsfase, die verschilt van cardiale remodellering van ECM-eiwitten in een laat stadium10,11,12. Deze veranderingen verstoren cel-ECM-interacties die vereist zijn voor celsignalering, functie en overleving13,14. Daarom kan het herstellen van de ECM in het infarct myocardium helpen bij het beperken van nadelige remodellering en uiteindelijk het verbeteren van de hartfunctie15,16 en zijn injecteerbare biomaterialen voorgesteld als therapieën voor dit doel17,18,19,20,21. Hoewel biomaterialen fysische stabiliteit kunnen bieden aan het infarct myocardium, kan deze eerder passieve structurele versterking alleen onvoldoende zijn om de hartfunctie op de lange termijn te ondersteunen. Daarom is een belangrijk kenmerk van injecteerbare biomaterialen dat ze kunnen worden ontworpen om te werken als een biomimetische matrix voor het ondersteunen van cellen en het stimuleren van infarctreparatie22,23,24. Verder is het gebruik van een biomimetisch platform dat in staat is endogeen weefselherstel te bevorderen een kritieke eigenschap voor veilige en effectieve klinische vertaling.
De gezonde cardiale ECM bestaat voornamelijk uit collagens type I (70%) en type III (12% )25. In MI-modellen voor dieren zijn biomaterialen op basis van collageen in staat geweest om mechanische ondersteuning te bieden, angiogenese en weefselintegratie te verbeteren, ontstekingen en apoptose te verminderen, en negatieve remodellering en het verlies van hartfunctie te beperken26,27,28,29,30,31. De veiligheid en werkzaamheid van een myocardiale ECM-hydrogel van varkens, voornamelijk samengesteld uit collagenen, werd vastgesteld in een preklinisch MI-model voor varkens19. Ondanks de belofte van biomaterialen voor harttherapie zijn er nog enkele beperkingen om te overwegen. Ten eerste zijn tot nu toe geteste biomaterialen van dierlijke oorsprong, die intrinsieke batch-tot-batch variabiliteit hebben als gevolg van isolatieprotocollen en inherente immuunrisico’s (d.w.z. endotoxinen) 32,33. Hoewel biomaterialen verder functieverlies hebben voorkomen wanneer ze vroeg na MI17,18,19,20,21 werden aangebracht, is ook een injecteerbaar materiaal nodig dat de hartfunctie kan verhogen wanneer het tijdens de late proliferatieve fase na acuut myocardinfarct wordt toegediend. In plaats van dierlijke componenten gebruiken we hier de eerste injecteerbare biomaterialen gemaakt van recombinante menselijke collagenen type I (rHCI) en type III (rHCIII) om een klinisch vertaalbaar materiaal voor harttherapie te produceren. Met name zijn deze eiwitten eerder gebruikt voor de fabricage van cornea-implantaten, waarvan is aangetoond dat ze veilig zijn bij transplantatie bij mensen34. We onderzoeken de pre-klinische prestaties van onze injecteerbare rHCI- en rHCIII-materialen in een gerenommeerd muismodel van MI35. Intramyocardiale injecties van rHCI of rHCIII worden toegediend aan muizenharten op 1 week na MI (aanvullende figuur 1 en aanvullende video 1), een model voor patiënten die vertraging hebben bij het krijgen van medische hulp (bijv. Afgelegen locatie, of negeer vroege tekenen na een hartaanval) of die niet adequaat reageren op conventionele behandeling en een groter risico lopen op ECM-remodellering en het ontwikkelen van hartfalen36,37. Dit tijdstip vormt de proliferatieve fase van infarct waarin littekenvorming wordt geïnitieerd (muizen: 2-7 dagen; mensen: 4-14 dagen), en is een uitstekende gelegenheid om in te grijpen om pathologische ECM-remodellering te beperken en infarctreparatie te bevorderen11,38 , 39,40. De primaire uitkomst is de hartfunctie bepaald door echocardiografie 28 dagen na de behandeling, en we beoordelen cardiale morfologie, ventriculaire remodellering, vascularisatie en ontsteking in het MI-hart in reactie op rHC-behandeling. Daarnaast gebruiken we in vitro-onderzoeken om uit te leggen hoe macrofagen interageren met de rHC-materialen. Onze resultaten benadrukken het potentieel voor een klinisch relevant biomateriaal op basis van menselijk recombinant collageen om te worden gebruikt als therapie voor de verbetering van de hartfunctie na MI door de bevordering van een wondgenezende omgeving, overleving van cardiomyocyten en verminderde pathologische remodellering.
resultaten
Synthese en karakterisatie van rHC-matrices De collageenformuleringen die in dit werk werden gebruikt, werden ontwikkeld als op warmte reagerende matrices om hun retentie in het myocardium te verzekeren bij intramyocardiale injectie. Bij het ontwerpen van de materialen was het doel om een geleringstijd van minder dan 10 minuten te hebben om voldoende tijd voor injectie in vloeibare vorm mogelijk te maken met minimale tijd vereist voor daaropvolgende gelering. Dezelfde totale concentratie collagenen (rHCI en rHCIII) en de verknopingsmiddelen N-ethyl-N- (3-dimethylaminopropyl) carbodiimide (EDC) en N-hydroxysuccinimide (NHS) werd gebruikt om de consistentie in de chemische samenstelling tussen de rHCI- en rHCIII-matrices. Onze rHC-matrices zijn ook geglycosyleerd en bevatten het glycosaminoglycan chondroïtinesulfaat C (fig. La). De hydrogels worden vervolgens in situ verknoopt en geassembleerd in een 3D-matrix om een biomimetische niche te verschaffen voor het bevorderen van endogeen herstel in het infarct myocardium.
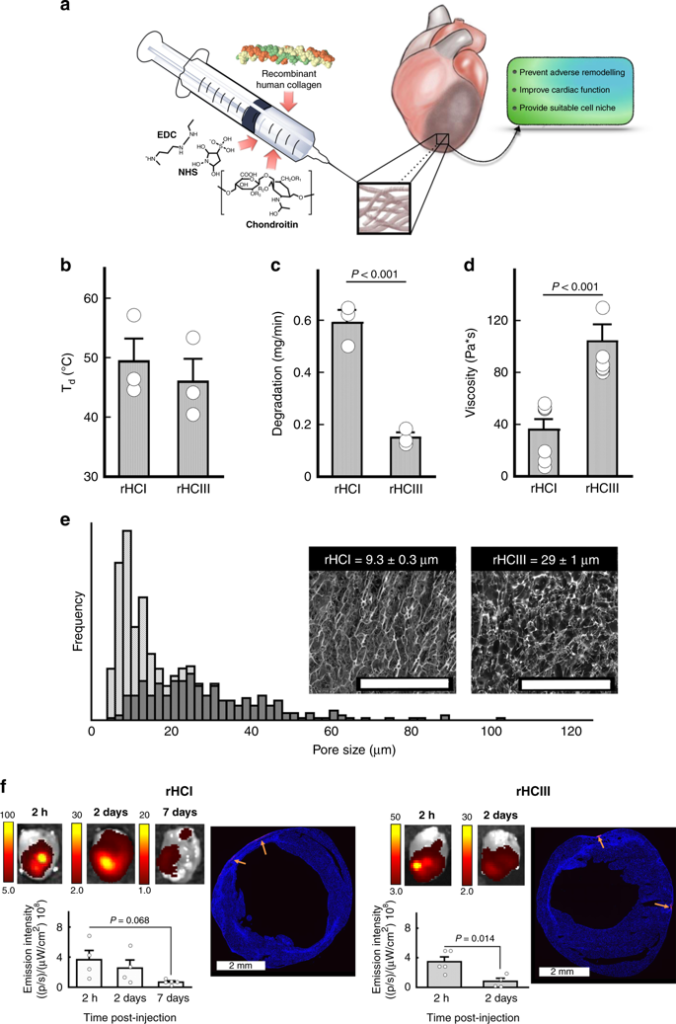
Bereiding en fysische karakterisering van injecteerbare rHC-matrices. een schematische weergave van de componenten, afgifte en reparatieve eigenschappen van het injecteerbare materiaal gepresenteerd in deze studie. b Denaturatietemperaturen (Td) (° C; n = 3), (c) in vitro afbraak in collagenase (mg / min; n = 3), en (d) viscositeitsmetingen (Pa · s; n = 7) voor rHCI en rHCIII-matrices. e Poriegrootteverdeling voor de rHCI (grijze balken) en rHCIII (zwarte balken) matrices berekend op basis van 250 individuele poriën per monster. Inzet: representatieve Cryo-SEM-afbeeldingen van de rHC-matrices. Schaalbalk = 200 µm. f Representatieve afbeeldingen van ex vivo beeldvorming van MI-muizenharten na 2 uur, 2 dagen of 7 dagen, na behandeling met de rHC-matrices, gelabeld met Alexa-Fluor®594-NHS-kleurstof. Onderste histogrammen tonen de gemiddelde totale fluorescentie-emissie voor de verschillende tijdstippen (n = 4). Ook worden representatieve histologische secties van het myocardium getoond 2 dagen na injectie. Pijlen geven representatieve gebieden aan die de collageenmatrices bevatten die zijn gemerkt met de fluorescerende kleurstof. P-waarden werden bepaald met een tweezijdige t-test. Voor b – d worden ± gegevens gepresenteerd als het gemiddelde ± SD en in f ± komt overeen met SEM. Brongegevens worden geleverd als brongegevensbestand. Voor b – e geeft n het aantal hydrogelbatches aan. Voor f is n het aantal muizen per groep

Geef een reactie