Meer dan 25 miljoen mensen lijden elk jaar aan hartfalen. In de Verenigde Staten ontvangen ongeveer 2500 van de 4.000 mensen die in de rij staan voor harttransplantaties deze daadwerkelijk. Dat betekent dat bijna 50% van de mensen die een nieuw hart nodig hebben om ze in leven te houden het niet zal krijgen. Maar nu hebben wetenschappers van het Massachusetts General Hospital en de Harvard Medical School met succes een menselijk hart laten groeien uit volwassen huidcellen in een laboratorium. Bovendien hebben onderzoekers van de Universiteit van Tel Aviv ‘s werelds eerste 3D-geprinte harten, een volledig gevasculariseerde, gemanipuleerde hart’ geprint ‘met behulp van de eigen cellen en biologische materialen van een patiënt. Hun onderzoek kan op een dag snel het tekortprobleem oplossen van harten waarmee de wereld vandaag wordt geconfronteerd.
Groei een hart
In het onderzoek van de wetenschappers van het Massachusetts General Hospital en de Harvard Medical School, groeiden ze een hart met stamcellen en schokten het vervolgens met een elektrische stroom om het tot leven te brengen.
Dit is wat ze deden:
- 73 donorharten die ongeschikt werden geacht voor transplantatie werden gebruikt.
- Ze namen huidcellen en veranderden ze in pluripotente stamcellen, het soort cellen dat kan worden gespecialiseerd in elk deel van het menselijk lichaam, met behulp van messenger RNA.
- Vervolgens zorgden ze ervoor dat de stamcellen zich ontwikkelden tot twee soorten hartcellen.
- De wetenschappers verwijderden cellen op de gedoneerde harten en vervingen ze door die getransformeerde huidcellen.
- Vervolgens bootsten ze de omgeving na waarin een menselijk hart meestal zou groeien en gaven de hartcellen een voedingsoplossing die de groei mogelijk maakte. Ze hebben de cellen daar twee weken achtergelaten.
- Na de twee weken schokten ze de harten met elektriciteit en het begon te kloppen. Bovendien bleek het weefsel binnenin goed gestructureerd en functioneel te zijn.
- De studie is gepubliceerd in Circulation Research.
Het team van wetenschappers schreef: Om aan te tonen dat functioneel myocardiaal weefsel van menselijke schaal op dit platform kan worden gebouwd, hebben we vervolgens gedeeltelijk menselijke steigers van het hele hart gerecellulariseerd met door mensen geïnduceerde pluripotente stamcel-afgeleide cardiomyocyten. Onder biomimetische kweek ontwikkelden de geënte constructen krachtgenererend menselijk myocardiaal weefsel en vertoonden elektrische geleidbaarheid, linkerventrikeldrukontwikkeling en metabole functie. Hun doel is om uiteindelijk een heel menselijk hart te laten groeien dat kan worden getransplanteerd.
Druk een hart af

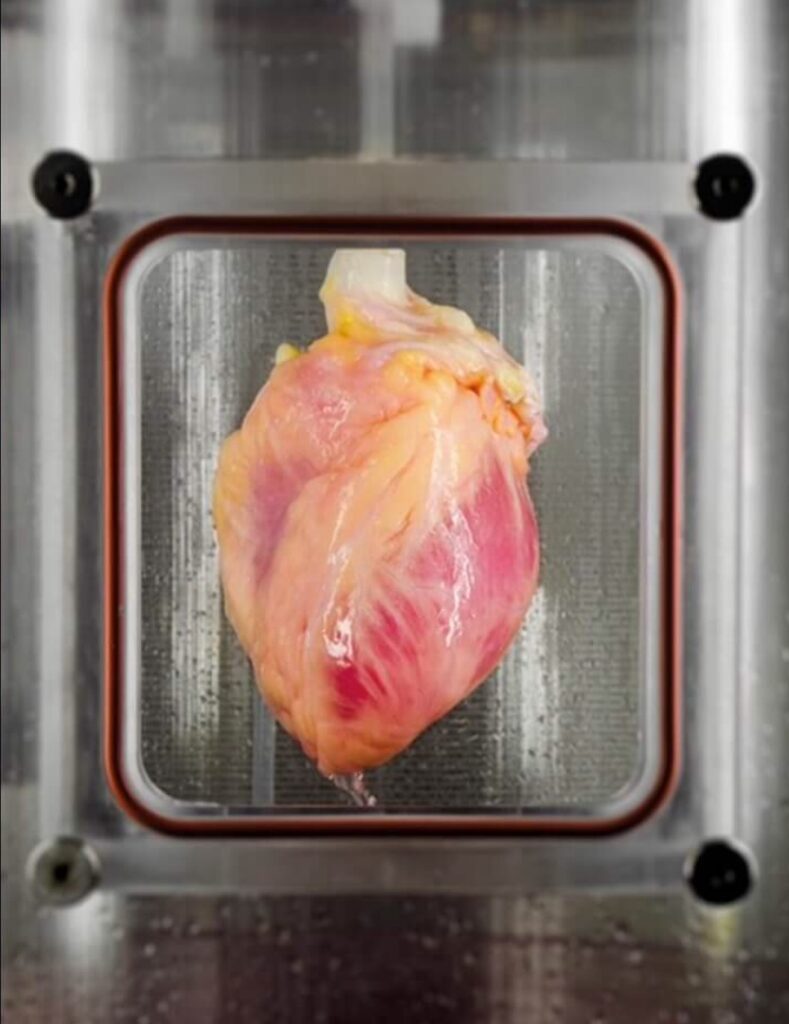
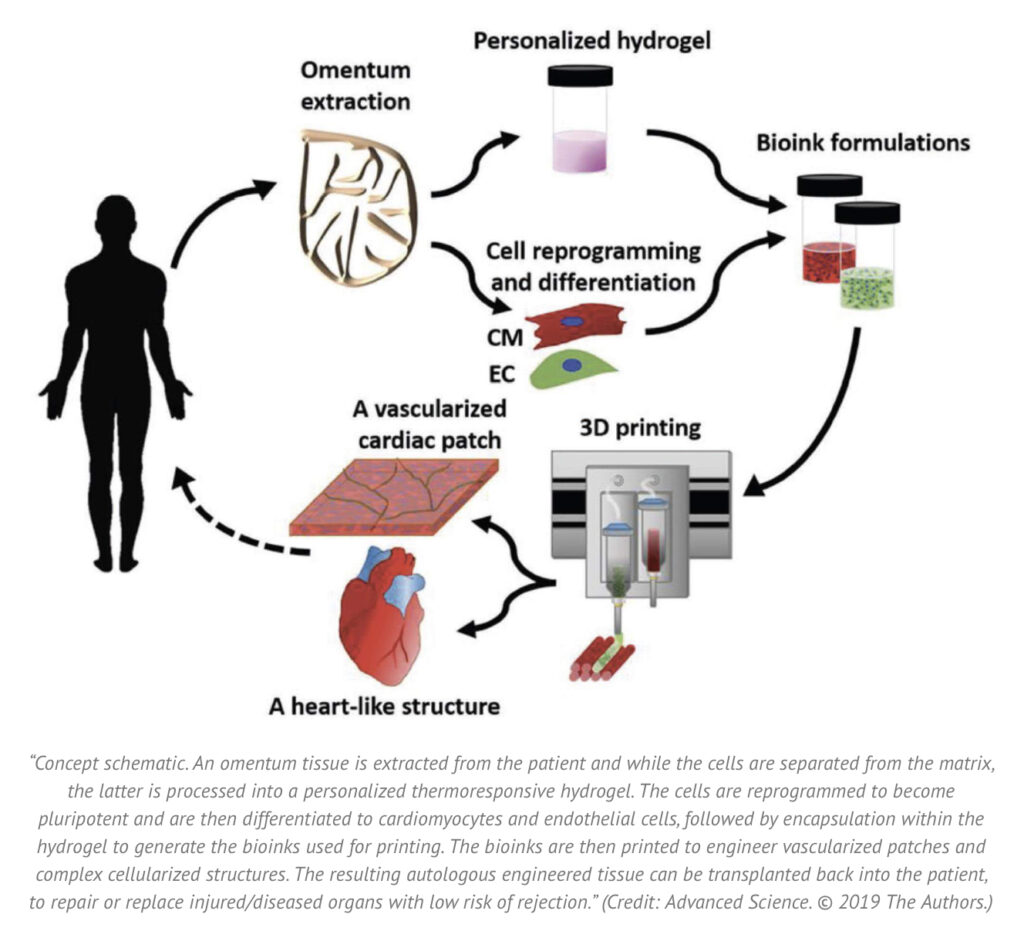
‘S Werelds eerste ‘3D-geprinte harten, dus gevasculariseerde, gemanipuleerde hart van de Universiteit van Tel Aviv komt volledig overeen met de immunologische, cellulaire, biochemische en anatomische eigenschappen van de patiënt omdat het de eigen cellen en biologische materialen van de patiënt gebruikt. Dit is wat ze deden:
- Eerst werd een biopsie van vetweefsel van patiënten genomen.
- Vervolgens werden de cellulaire en a-cellulaire materialen van het weefsel gescheiden.
- Terwijl de cellen opnieuw werden geprogrammeerd om pluripotente stamcellen te worden, werd de extracellulaire matrix (ECM), een driedimensionaal netwerk van extracellulaire macromoleculen zoals collageen en glycoproteïnen, verwerkt tot een gepersonaliseerde hydrogel die diende als de drukinkt.
- Na te zijn gemengd met de hydrogel, werden de cellen efficiënt gedifferentieerd naar hart- of endotheelcellen om patiëntspecifieke, immuun-compatibele hartpleisters met bloedvaten en vervolgens een heel hart te creëren.
- Hun bevindingen werden gepubliceerd in het tijdschrift Advanced Science.
Prof. Tal Dvir van TAU’s School of Molecular Cell Biology and Biotechnology, Department of Materials Science and Engineering, Centre for Nanoscience and Nanotechnology and Sagol Centre for Regenerative Biotechnology, die het onderzoek leidde voor de studie, zei:
Dit is de eerste keer dat iemand met succes een heel hart vol met cellen, bloedvaten, ventrikels en kamers heeft ontworpen en als 3D-geprinte harten gemaakt … Dit hart is gemaakt van menselijke cellen en patiëntspecifieke biologische materialen. In ons proces dienen deze materialen als de bioink, stoffen gemaakt van suikers en eiwitten die kunnen worden gebruikt voor 3D-printen van complexe weefselmodellen. Mensen hebben in het verleden de structuur van een hart 3D-geprint, maar niet met cellen of met bloedvaten. Onze resultaten tonen het potentieel van onze aanpak voor de engineering van gepersonaliseerde weefsel- en orgaanvervanging in de toekomst … In dit stadium is ons 3D-hart klein, de grootte van het hart van een konijn. Maar grotere menselijke harten vereisen dezelfde technologie.
Het gebruik van “native” patiëntspecifieke materialen is cruciaal voor het succesvol engineeren van weefsels en organen.
Prof. Dvir zei:
De biocompatibiliteit van technisch materiaal is cruciaal om het risico op afstoting van implantaten te elimineren, wat het succes van dergelijke behandelingen in gevaar brengt. Idealiter zou het biomateriaal dezelfde biochemische, mechanische en topografische eigenschappen moeten hebben van de eigen weefsels van de patiënt. Hier kunnen we een eenvoudige benadering van 3D-geprinte dikke, gevasculariseerde en perfuseerbare hartweefsels melden die volledig overeenkomen met de immunologische, cellulaire, biochemische en anatomische eigenschappen van de patiënt.
De onderzoekers zijn momenteel van plan om de bedrukte harten in het lab te kweken en ‘te leren ze te gedragen’ als harten; dan zullen ze ze in diermodellen transplanteren. Prof. Dvir zei:
We moeten 3D-geprinte harten verder ontwikkelen. De cellen moeten een pompvermogen vormen; ze kunnen momenteel contracteren, maar we hebben ze nodig om samen te werken. Onze hoop is dat we zullen slagen en de effectiviteit en bruikbaarheid van onze methode zullen bewijzen. Misschien zijn er over tien jaar orgelprinters in de beste ziekenhuizen ter wereld en worden deze procedures routinematig uitgevoerd.
Vertaald met google translate
12 juli 2019

Geef een reactie